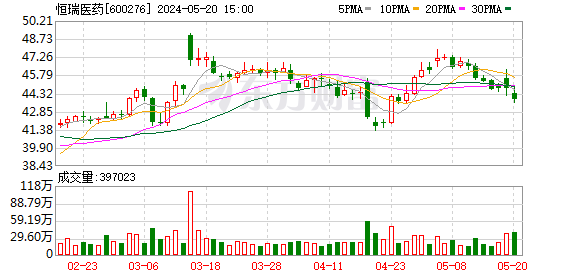
5月8日晚间,恒瑞医药(600276)发布公告称,其子公司成都盛迪药业有限公司和福建盛迪药业有限公司分别收到国家医药产品监督管理局批准的《药物临床试验批准通知书》,并将于近期开展临床试验。
其中一种药物是注射用HRS5580。公告称,经审查,2月7日受理的注射用HRS5580临床试验申请符合药品注册相关要求,国家医药产品监督管理局同意开展该产品临床试验,申请适应症为预防术后恶心呕吐。
恒瑞医药表示,注射用HRS5580通过拮抗NK-1受体,具有溶解性高、安全性好的优点。目前国内尚无同类注射液产品上市。注射用HRS5580相关项目累计投入研发费用约2087万元。
另一种药物HRS-5965胶囊也获准进行临床试验。该药物应用的适应症是:用于治疗由补体介导的原发性或继发性肾小球疾病,如IgA肾病、特发性膜性肾病、C3肾病和狼疮性肾炎;补体介导的溶血性贫血。
据该公司称,HRS-5965胶囊可以通过抑制补体系统的过度激活来抑制补体系统介导的溶血。临床前研究结果表明,其在补体介导的溶血模型中具有显著的抑制作用,且具有良好的安全性。经查询,国内尚未有类似产品获批上市。截至目前,HRS-5965相关项目累计投入研发费用约6407万元。
恒瑞医药表示,根据相关法律法规要求,药品在收到《批准临床试验通知书》后,仍需开展临床试验并经国家医药产品管理局审评批准后方可生产上市。同时,从药物研发、临床试验批准到生产的周期长、环节多,因此药物研发和上市容易受到一些不确定因素的影响。
(文章来源:证券时报)